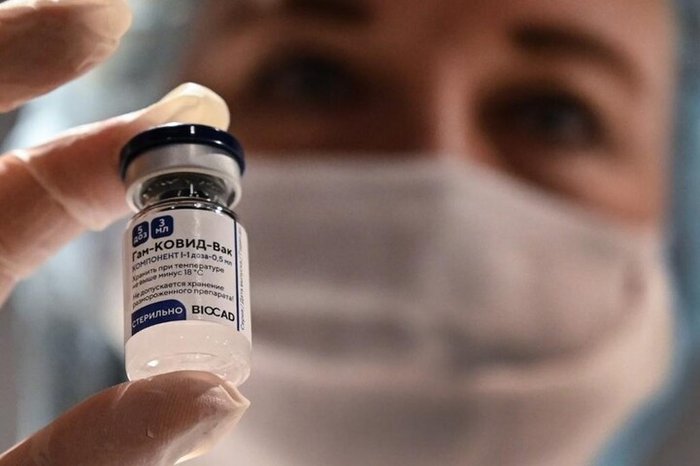
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta sexta-feira (4), com condicionantes, pedidos de importação de vacinas contra a covid-19 fabricadas na Rússia, pelo Instituto Gamaleya, e na Índia, pelo laboratório Bharat Biotech. De acordo com lei aprovada neste ano, com a autorização, se forem seguidas as recomendações condicionantes, os Estados e o Ministério da Saúde ficam aptos a distribuir e aplicar os imunizantes Sputnik V e Covaxin especificamente aprovados pela diretoria colegiada da Anvisa.
Tanto os Estados solicitantes quanto o governo brasileiro deverão fazer uso controlado dessas vacinas na população se forem realmente importadas. Os condicionantes foram interpostos devido à falta de documentação e dados que demonstrem o controle necessário de qualidade das fórmulas.
A autorização para importação não é a mesma coisa que aprovação do uso emergencial dos imunizantes na população, como é o caso da CoronaVac. Um dos condicionantes aprovados diz respeito à obrigação dos gestores de informar amplamente à sociedade que esses imunizantes importados não possuem avaliação da Anvisa quanto aos critérios de qualidade, eficácia e segurança.
A Sputnik V e a Covaxin importadas de plantas específicas da Rússia e da Índia foram autorizadas extraordinariamente porque uma lei aprovada pelo Congresso Nacional neste ano dispensou análise mais contundente da Anvisa de vacinas já aprovadas em órgãos de vigilância de determinados países. O pedido de importação da Covaxin foi feito pelo Ministério da Saúde. Já o pedido da Sputnik V foi feito por Bahia, Maranhão, Sergipe, Ceará, Pernambuco, Piauí.
O gerente-geral de Medicamento e Produtos Biológicos, Gustavo Mendes, primeiro técnico a expor dados técnicos à diretoria colegiada, recomendou que, se aprovada, a Sputnik V tenha condicionantes pelos Estados que estão pedindo essa autorização. Entre as condicionantes estão a distribuição e a utilização de vacinas em ambiente controlado e com condução de estudos de efetividade, além de usar apenas doses de plantas já inspecionadas pela agência. Antes de serem aplicadas, as doses devem ser aprovadas pelo Instituto Nacional de Controle de Qualidade em Saúde, que fará análise sobre a existência ou não de adenovírus replicantes nas doses.
Anteriormente, a agência havia rejeitado o pedido de ambos por falta de dados sobre a produção e segurança dos imunizantes. Um dos motivos pela negativa era a presença de adenovírus replicantes em doses analisadas. O adenovírus é o vírus causador do resfriado em humanos. Ele é usado como vetor viral em parte das vacinas. Em todas elas, os adenovírus são inativados, ou seja, perdem sua capacidade de se multiplicar no organismo humano. Quando não são inativados, eles são replicantes, ou seja, capazes de se multiplicar e atuar para que a pessoa que tomou a injeção fique doente.
Tanto para aprovação de importação da Covaxin quanto da Sputnik V, os Estados solicitantes e o Ministério da Saúde deverão disponibilizar às unidades de saúde as informações de rótulos e bulas que sejam importantes para o uso correto do produto, no idioma português. Os Estados deverão suspender a importação, distribuição e uso caso a Anvisa ou a Organização Mundial da Saúde (OMS) reprovem o uso emergencial dessas vacinas.
Os condicionantes impostos para a importação da Covaxin são quase os mesmos aplicados aos da Sputnik V. Exclui-se a análise de presença de adenovírus, mas inclui-se a necessidade de análise do Instituto Nacional de Controle de Qualidade em Saúde, desta vez para demonstrar a potência da vacina, o conteúdo antigênico e a sua qualidade.
Além de Gustavo Mendes, a gerente da área de Inspeção e Fiscalização Sanitária, Ana Carolina Moreira Marino, e a gerente da área de monitoramento de produtos sujeitos à Vigilância Sanitária, concordaram com o estabelecimento das condicionantes para a vacina Sputnik V e também recomendaram a aprovação do imunizante com ressalvas. Já sobre a Covaxin, Ana Carolina apresentou que a fábrica de onde será importada essa vacina tem certificação de boas práticas e recomendou a aprovação no que diz respeito à sua área.
Por falta de demonstração de qualidade e por falta de documentação e dados, em 26 de abril, a Anvisa havia negado o pedido de importação da Sputnik. Em 31 de março, negou a importação da Covaxin.
O governo, por meio do Ministério da Saúde, já adquiriu 10 milhões de doses da Sputnik V (no Brasil, envasada pela União Química) e 20 milhões da Covaxin (Precisa Medicamentos). A vacina russa também foi comprada por governadores do Norte, Nordeste e Centro-Oeste.
Restrições
A Anvisa também listou as restrições de uso das vacinas. Não poderão recebê-las pessoas que tenham:
- recebido outra vacina contra covid-19
- febre, HIV, hepatite B ou C
- se vacinado nas quatro semanas anteriores
- recebido imunoglobulinas ou hemoderivados três meses antes
- recebido tratamentos com imunossupressores, citotóxicos, quimioterapia ou radiação 36 meses antes
- recebido terapias com biológicos incluindo anticorpos anticitocinas e outros anticorpos
A vacina também não deverá ser utilizada por:
- pessoas com hipersensibilidade a qualquer dos componentes da fórmula
- grávidas, lactantes, menores de 18 anos, mulheres em idade fértil
- mulheres que desejam engravidar nos próximos 12 meses
- pessoas com enfermidades graves ou não controladas (cardiovascular, respiratória, gastrointestinal, neurológica, insuficiência hepática, insuficiência renal, patologias endócrinas) e antecedentes de anafilaxia
Doses autorizadas
Sputnik
- Bahia – 300 mil
- Maranhão – 141 mil
- Sergipe – 46 mil
- Ceará – 183 mil
- Pernambuco – 192 mil
- Piauí – 66 mil
Covaxin
- 4 milhões de doses para o país