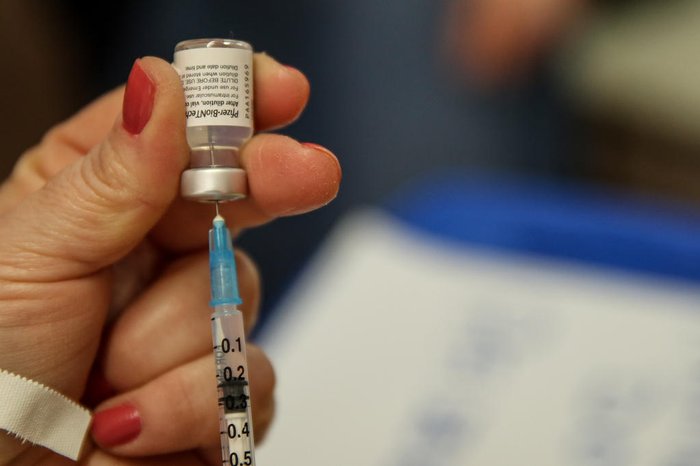
A norte-americana Pfizer e a parceira alemã BioNTech pediram, nesta quinta-feira (7), autorização à Food and Drug Administration (FDA, na sigla em ingles – agência regulatória de alimentos e medicamentos dos Estados Unidos) para o uso emergencial de sua vacina contra covid-19 em crianças de cinco a 11 anos, público estimado em 28 milhões de pessoas no país. A informação é do jornal The York Times.
De acordo com a publicação, a FDA prometeu avaliar o pedido com agilidade. Há expectativa para que a resposta saia em 26 de outubro, data em que a agência marcou reunião para discutir o pedido da Pfizer.
Em setembro, as farmacêuticas divulgaram que ensaios mostraram que sua vacina é segura e gera forte resposta imunológica nesta faixa etária. Para crianças em idade escolar, a Pfizer testou uma dose muito mais baixa - um terço da quantidade que está em cada injeção dada nas demais faixa etária. Mesmo assim, após a segunda dose, crianças de cinco a 11 anos desenvolveram níveis de anticorpos que combatem o coronavírus, afirmou a empresa.
A dosagem para crianças também se mostrou segura, com efeitos colaterais temporários semelhantes ou mais leves que os experimentados pelos adolescentes. O estudo envolveu 2.268 alunos do jardim de infância e crianças em idade escolar.
A vacina fabricada pela Pfizer/ BioNTech já está disponível para qualquer pessoa com 12 anos ou mais em vários países, entre eles o Brasil.
As farmacêuticas pretendem submeter a mesma solicitação feita à FDA para a Agência Europeia de Medicamentos e a outros órgãos regulatórios, segundo comunicado conjunto divulgado em 28 de outubro.