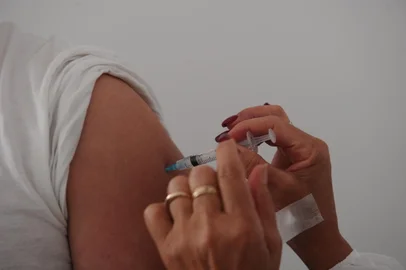
A agência reguladora responsável pela autorização de medicamentos nos Estados Unidos, a Food and Drug Administration (FDA), concedeu, nesta sexta-feira (11), aval para que a vacina da Pfizer/BioNTech seja utilizada no país. É a primeira autorização emergencial concedida pelo órgão do governo norte-americano, e é o ponto de partida para uma campanha nacional de vacinação no país, que deve começar na próxima semana.
Na quinta (10), o comitê de especialistas da FDA havia recomendado a aprovação do imunizante. Após duas doses, a vacina foi considerada segura, sem efeitos colaterais graves, e 95% eficaz na prevenção da covid-19, doença causada pelo coronavírus.
A primeira dose deve começar a proteger o paciente após 10 dias, mas menos do que com a dose complementar, três semanas depois.
— As respostas imunes provocadas pelo RNAm (RNA mensageiro) são semelhantes às da infecção natural. Mas, é claro, a vacina de RNAm não é infecciosa e não pode causar doenças — disse Kathrin Jansen, diretora de vacinas da Pfizer, durante uma sessão de perguntas e respostas com o comitê.
Os Estados Unidos são o país mais afetado pela pandemia, com 15,6 milhões de casos confirmados e mais de 292 mil mortes, segundo os dados da Universidade Johns Hopkins, que são usados como referência. Com a autorização, o plano de vacinação norte-americano começará a entregar as doses diretamente aos hospitais e farmácias, que vão vacinar os grupos prioritários: residentes de lares de idosos e profissionais da saúde.
A vacina já começou a ser aplicada no Reino Unido. As autoridades de saúde britânicas, entretanto, desaconselharam o uso em pessoas com reações alérgicas significativas.